(Innovationen im Kampf gegen das Metabolische Syndrom: Neue Wege und Strategien)
Die deutsche Bevölkerung wird zwar (noch) immer älter, aber auch zusehends kränker. Es ist zu befürchten, dass dieser Aufwärtstrend, verursacht durch bessere Lebensbedingungen und medizinische Versorgung in der Lebenserwartung, in Zukunft stagnieren, wenn nicht gar rückläufig werden wird. Allerdings kann jeder einzelne in der aktuellen Situation zumindest zum Teil dafür sorgen, dass er möglichst gesund bleibt. In diesem Artikel sind die Zusammenhänge genauer geschildert und erstmals mein gesamtes Anti Aging-Konzept in Kürze dargestellt.
Der ,,Super-Gau“ als Folge der Fehlernährung ist das sogenannte metabolische Syndrom. Darunter versteht man eine Kombination aus mehreren Risikofaktoren, darunter Bluthochdruck, Insulinresistenz, Fettstoffwechselstörungen und zuvel Fett im und um den Bauch (abdominale Adipositas), die zusammen das Risiko für Herz-Kreislauf-Erkrankungen und Typ-2-Diabetes erhöhen. Das metabolische Syndrom ist in Deutschland weit verbreitet. Schätzungen zufolge leiden etwa 20 bis 25 Prozent der erwachsenen Bevölkerung daran. Bei älteren Erwachsenen, insbesondere in der Altersgruppe der 50- bis 70-Jährigen, kann dieser Anteil bis zu 40 Prozent betragen .
Die Hauptursachen des metabolischen Syndroms sind Bewegungsmangel und eine unausgewogene, kalorienreiche Ernährung. Weitere begünstigende Faktoren sind erhöhter Alkoholkonsum, Rauchen, anhaltender Stress und Vorerkrankungen wie Nieren- oder Lebererkrankungen.
.Erst in den letzten Jahren hat man die Zusammenhänge des metabolischen Syndroms richtig verstanden, was neue Wege bei der Prävention und Therapie öffnet. Keinen Tag zu früh, denn mittlerweile ist zu einer der führenden Ursachen für vorzeitige Morbidität und Mortalität geworden. Heute weiß man, dass die Hauptursache des Anstiegs dieser multifaktoriellen Erkrankung, bei der durch die Industrialisierung stark veränderten Ernährung zu suchen ist, verbunden mit einem deutlichen Bewegungsmangel, wodurch die metabolischen Prozesse im Körper negativ beeinflusst werden können.
Aber glücklicherweise hat sich unser Verständnis der molekularen Grundlagen des metabolischen Syndroms In den letzten Jahren erheblich erweitert. Durch intensive Forschungen wurden beispielsweise innovative Labor-Techniken gefunden, die die Identifikation von Risikofaktoren erleichtern. Dadurch wurden präventive und therapeutische Maßnahmen möglich gemacht, die über die traditionellen Ansätze hinausgehen.
Bei den pharmakologischen Therapien sind jene erwähnenswert, die gezielt auf Insulinsensitivität, den Lipidmetabolismus und entzündliche Prozesse abzielen, gleichzeitig gewinnen nicht-pharmakologische Präventions- und Behandlungs-Strategien wie personalisierte Ernährung und umfassende Lebensstil-Interventionen an Bedeutung.
Heutzutage ist es möglich, einen sehr differenzierten, individualisierten Ernährungsplan zu erstellen, bei dem man die Lebensmittel nicht nur nach vorgefertigten Plänen und eventuell noch unter Berücksichtigung der persönlichen Vorlieben auswählt, sondern auch nach individuellen Laborergebnissen im Bereich der Genetik, Mikrobiomik und Metabolomik.
Zudem hat sich auch bei der Nahrungs-Supplementation einiges getan. Mittlerweile hat man erkannt, dass an manchen Nährstoffen tatsächlich auch in Deutschland ein relativ häufiger Mangel herrscht, wie beispielsweise an Vitamin D, K2 und Jod. Andere, zum Teil etwas in Vergessenheit geratene Nahrungsergänzungsmittel haben zudem therapeutischen Nutzen, wie beispielsweise Knoblauch, über den es hervorragende Studien beispielsweise bei der Thrombozytenaggregations- und Entzündungs-Hemmung gibt. Noch nicht etabliert, aber durchaus eine Überlegung wert, ist die Gaben von s GLP-1-Rezeptoragonisten zur Gewichtsreduktion und/ oder Metformin schon bei Hinweisen auf eine Insulinresistenz.
Wie solch eine moderne Therapiefindung zur diätischen Behandlung eines metabolischen Syndroms aussehen kann, wird in diesem Artikel exemplarisch an einer Falldarstellung dargelegt.
Dabei wird aber auch die individuelle Motivation und der Beachtung persönlicher Einstellungen aufgezeigt, der lange Zeit zu wenig Beachtung geschenkt wurde. Denn nur so können die langfristigen Ernährungsgewohnheiten beiseite geschoben werden, um einer gesunden Ernährung Platz zu machen, die nicht nur zu einer Prävention bzw. zum Rückgang der Symptome des metabolischen Syndroms geeignet ist, sondern auch zu neuer Vitalität führt und ganz nebenbei dem Patienten sogar Freude bereiten kann.
Die Entwicklung des metabolischen Syndroms
Wenden wir uns zuerst der Frage zu, wie es überhaupt zu einem metabolischen Syndrom kommt. Die moderne Ernährungsweise, oft geprägt durch hohe Mengen an verarbeiteten Lebensmitteln, zugesetzten Zuckern und gesättigten Fetten, beeinflusst den menschlichen Körper auf molekularer Ebene. In folgendem Kapitel werden die molekularen Veränderungen, die durch die aktuelle Ernährungsweise induziert werden, erklärt und die damit verbundenen medizinischen Fallstricke. identifiziert.
In Abbildung 1 sieht man wie komplex bei der Entwicklung die einzelnen Mechanismen ineinandergreifen. Der häufige Konsum an gesättigten Fetten und Transfetten, können Entzündungsprozesse im Körper fördern Zwei Punkte stehen mit den anderen besonders häufig in Verbindung: Zum einen das Entzündungsgeschehen im Körper, das durch Feed-Back-Mechanismen auch durch sich selbst getriggert wird und zum anderen die Insulinresistenz. Bei Adipositas verändert sich die Fettzelle (Adipozyt) in der Regel durch eine Zunahme der Fettansammlung innerhalb der Zelle. Diese Ansammlung führt dazu, dass die Zellen anschwellen und ihr Volumen deutlich vergrößern. Diese Vergrößerung kann die normale Zell-Funktion der Fettzellen beeinträchtigen und dazu führen, dass sie proinflammatorischer Zytokine wie TNF-alpha und IL-6 erhöhen. Diese Zytokine spielen eine wichtige Rolle in der Entwicklung von chronischen Entzündungen, die mit einer Vielzahl von Krankheiten, einschließlich Herz-Kreislauf-Erkrankungen und Diabetes, assoziiert sind. Die Aktivierung dieser entzündlichen Signalwege auf molekularer Ebene kann zu einer systemischen Entzündungsreaktion führen, die die Zellfunktion beeinträchtigt und das Risiko für chronische Erkrankungen erhöht.
.Der häufige Verzehr von hochglykämischen Lebensmitteln, die schnell Glukose freisetzen, führt zu einer chronischen Hyperglykämie. Dadurch werden die Beta-Zellen der Bauchspeicheldrüse angeregt, mehr Insulin zu produzieren, was langfristig zu einer Überlastung der Insulinrezeptoren und schließlich zur Insulinresistenz führt.
Viszerale Adipositas fördert die Freisetzung von entzündungsfördernden Zytokinen wie TNF-α und IL-6, die Entzündungen verstärken und die Insulinsensitivität weiter reduzieren. Eine gestörte Fettstoffwechselregulation führt zu erhöhten Triglyceridspiegeln und niedrigem HDL-Cholesterin, was die atherosklerotische Plaquebildung fördert. Oxidativer Stress und chronische Entzündungen schädigen die Endothelzellen der Blutgefäße, was zur Entstehung von Bluthochdruck und kardiovaskulären Erkrankungen beiträgt.
Moderne Ernährungsgewohnheiten, die arm an Ballaststoffen und reich an verarbeiteten Lebensmitteln sind, können auch die Diversität und Funktion des Darmmikrobioms beeinträchtigen. Eine verminderte mikrobielle Vielfalt kann die Integrität der Darmschleimhaut schwächen und die Permeabilität erhöhen, was als „Leaky Gut“ bekannt ist. Diese Veränderungen auf molekularer Ebene können zur Translokation von Endotoxinen führen und systemische Entzündungsreaktionen auslösen, die weitere gesundheitliche Komplikationen begünstigen.
Die Ernährung kann auch direkt die Expression bestimmter Gene beeinflussen. Diäten, die reich an verarbeiteten Lebensmitteln und arm an Mikronährstoffen sind, können die Expression von Genen modulieren, die an Entzündungsprozessen, Zellzyklusregulation und Insulinsignalisierung beteiligt sind. Diese epigenetischen Veränderungen können dauerhafte Auswirkungen auf die Gesundheit haben und das Risiko für verschiedene Krankheiten erhöhen.
Fazit
Die modernen Ernährungsgewohnheiten führen zu signifikanten molekularen Veränderungen, die das Risiko für metabolisches Syndrom, Herz-Kreislauf-Erkrankungen, Diabetes und andere entzündliche Erkrankungen erhöhen. Um diesen negativen Auswirkungen entgegenzuwirken, ist eine Umstellung auf eine ausgewogene, nährstoffreiche Ernährung unerlässlich. Dies beinhaltet den vermehrten Verzehr von Vollkornprodukten, frischem Obst und Gemüse sowie die Reduktion von verarbeiteten Lebensmitteln und zuckerreichen Getränken. Zudem ist es wichtig, dass sowohl individuelle als auch öffentliche Gesundheitsstrategien entwickelt und gefördert werden, die auf die Förderung von gesunden Ernährungspraktiken abzielen, um langfristig die öffentliche Gesundheit zu verbessern und die Belastung durch chronische Krankheiten zu verringern.
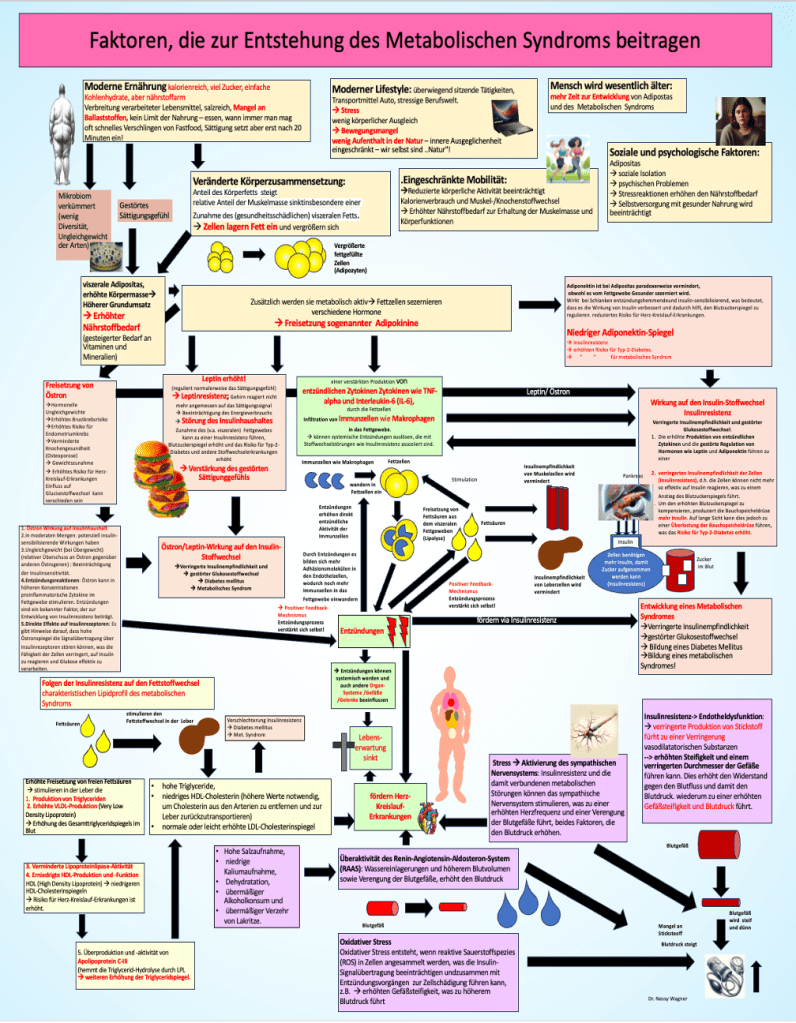
Abbildung 1: Komplexe Zusammenhänge der Entstehung des metabolischen Syndroms.
Prävention des metabolischen Syndroms durch innovative Ernährungsansätze in der Zukunft
Bei der Prävention und Behandlung des metabolischen Syndrom gilt es an erster Stelle, dem Patienten die Bedeutung eines veränderten Lifestylemanagement mit ausreichend körperlicher Bewegung und einer Stressreduktion im Alltag nahezulegen. Zudem kommt der richtigen Ernährung eine besondere Bedeutung zu. Dabei hat sich herauskristallisiert, dass eine Mittelmeerdiät, die reich an Obst und Gemüse ist, aber auch Samen und Nüsse inkludiert (sofern keine Allergien bestehen) sowie den Verzehr von Seefisch ein bis zweimal pro Woche mit einem geringeren Risiko für viele chronische Krankheiten, einschließlich metabolischem Syndrom, verbunden ist. Forschungsergebnisse weisen darauf hin, dass insbesondere grünes Blattgemüse und tief gefärbtes Obst wie Beeren, die reich an sekundären Pflanzen-Stoffen sind, gut geeignet scheinen, um die Symptome des metabolischen Syndrom positiv zu beeinflussen.

Abbildung 2: Eine Algenfarm in Küstennähe hilft, nährstoffreiche Algen zur Produktion einer ganz neuen Art von Nahrungsmittel zu produzieren

Abbildung 3: Beim Tissue-Engineering werden auf einem Gerüst (z.B. mittels 3-D-Drucker gedruckt)tierische Zellen aufgebracht und durch eine Nährlösung ernährt, sodass sich essbares, fleischähnliches Gewebe bildet. Allerdings ist dieses Herstellungserfahren aktuell noch sehr teuer.
Blickt man jedoch in die Zukunft, wird klar, dass wir angesichts der steigenden Weltbevölkerung, des Klimawandels und der steigenden Kosten viele der herkömmlichen Nahrungsmittel unsere Ernährung durch neue, nachhaltige und nährstoffreiche Nahrungsquellen ersetzen müssen. So wird man zukünftig im Labor künstliches Fleisch züchten („Zellbasierte Fleischproduktion“ oder „In-vitro-Fleischproduktion“). Dabei werden tierische Zellen in einer kontrollierten Umgebung kultiviert, um essbares Fleisch zu erzeugen, das die Notwendigkeit der Tierhaltung umgeht. Beim sogenannten ,,Tissue Engineering“ wird ein biokompatibles Gerüst zur Züchtung artifiziellen Gewebes (,,künstliches Fleisch“) verwendet.
Daneben können auch Käfer und Würmer als nahrhafte Proteinquellen genutzt werden, aber auch verschiedene Pflanzenarten haben das Potential, die Ernährung der Zukunft revolutionieren.
Dazu gehören Züchtungen verschiedener Algensorten (Abb.2), die in großen Mengen unter Wasser gedeihen und teilweise auch im Meer gezüchtet werden können, aber auch Landpflanzen, beispielsweise die Quinoa Pflanze, die alle neun essentiellen Aminosäuren enthält und an verschiedene Klimazonen anpassungsfähig ist, oder auch Amaranth, der durch hohe Gehalte an Proteinen, Ballaststoffen und Mikronährstoffen wie Eisen und Magnesium punkten kann.
Auch der Moringa-Baum (Abb.4), der oft als „Wunderbaum“ bezeichnet wird, könnte in der zukünftigen Ernährung eine zunehmend wichtige Rolle spielen, insbesondere in Regionen, die von Nahrungsmittelunsicherheit und Unterernährung betroffen sind. Neben einem Hoher Nährstoffgehalt, besonders der Blätter, passt er sich gut an verschiedene klimatische Bedingungen an und ist äußerst robust. So kann er auch in trockenen, dürregefährdeten Gebieten gedeihen, zudem wächst er schnell und lässt sich einfach kultivieren. Alle Teile des Moringa-Baums können genutzt werden. Die Blätter und Schoten können gegessen werden, während die Samen zur Wasserreinigung verwendet werden können, da sie Öle und Proteine enthalten, die helfen, Schmutzpartikel und Bakterien aus dem Wasser zu entfernen. Zudem werden ihm einige gesundheitliche Vorteile zugeschrieben, darunter entzündungshemmende Wirkungen, Unterstützung der Blutzuckerkontrolle und Verbesserung der Cholesterinwerte.

Abbildung 4: Hier ist die Zeichnung der Moringa-Pflanze. Sie zeigt die schlanke, baumartige Struktur mit mehreren Ästen, die gefiederten, tiefgrünen Blätter und die kleinen, ovalen Blättchen.
Kernza ist ein mehrjähriges Getreide mit tiefen Wurzeln, das weniger Wasser und Düngemittel benötigt und den Boden verbessert oder die Jackfrucht, die ist reich an Kohlenhydraten, Ballaststoffen, Vitaminen und Mineralstoffen und als Fleischersatz verwendet werden kann.
Diese Pflanzenarten bieten hohe Nährstoffdichten und tragen zur ökologischen Nachhaltigkeit bei. Durch ihre Anpassungsfähigkeit und vielfältigen Vorteile könnten sie in der Zukunft eine entscheidende Rolle in der globalen Ernährungssicherung spielen.
Die Bedeutung von Nahrungsergänzungsmittel am Beispiel von Knoblauch-Präparaten
Es besteht kaum mehr ein Zweifel daran, dass die Supplementierung manche Nahrungesergänzungsmittel, bei Erkrankungen des metabolischen Formenkreises supportiv wirken können. Hierzu zählen, zumindest saisonal gegeben, eine Kombination, aus Vitamin D3 und K2 und evtl. Calcium, wobei Vit. D3 für die Aufnahmen von Calcium aus dem Darm verantwortlich ist und K2 dafür, dass Calcium in den Knochen und nicht in die Gefäße aufgenommen wird, wo es Atherosklerose begünstigen würde, zudem Magnesium, Omega-3-Fettsäuren, B-Vitamine (besonders bei Menschen, die wenig Fleisch essen), ebenso Eisen und Jod (wenn kaum Seefisch gegessen wird, Jodsalz allein reicht nicht!).
Es gibt allerdings ein pflanzliches Mittel, das trotz hervorragender Studienlage gerade bei metabolischen Erkrankungen ein wenig in Vergessenheit geraten ist. Die Rede ist von Knoblauch, das in ausreichenden Mengen tatsächlich mit allen Eigenschaften aufwarten kann, die man von einem modernen Therapeutikum erwartet. Hierzu möchte ich auch kurz auf einige exemplarische Studien eingehen: Knoblauch (Allium sativum) hat sich als nützliche Nahrungsergänzung beim metabolischen Syndrom erwiesen, da er sowohl präventiv als auch kurativ auf verschiedene Faktoren des Syndroms einwirkt, darunter Entzündungshemmung (Rahman et al, 2006), Fettsenkung, (Ried et al, 2013) Hemmung der Thrombozytenaggregation (Banerjee et al 2002; Kiesewetter et al; 1996), Senkung des Blutdrucks Ried, K . 2008) und Verbesserung der Insulinresistenz (Ashraf, R. et.al. 2005).
Eine individuelle Beratung ist essenziell, um die richtigen Ergänzungen und Dosierungen zu bestimmen und mögliche Wechselwirkungen mit bestehenden Medikamenten zu vermeiden.
Bedeutung von Nahrungspausen/ Intervallfasten beim metabolischen Syndrom
Für den Patient ist es sehr wichtig, dass er versteht, welche Bedeutung der Verzehr von einfachen Kohlenhydraten für seinen Körper hat und warum der Körper kaum eine Chance hat, sich auf die Energiegewinnung aus Fett (um Fett abbauen zu können) umzustellen, wenn immer dann, wenn dies kurz bevorsteht, wieder Kohlenhydrate zugeführt werden (Abb. 5). Über Jahrtausenden waren Essenspausen für den Körper ganz normal. Es gab Zeiten der reichhaltigen Ernährung, meist aber auch Zeiten der Mangelernährung, in der die Fettreserven den Menschen vorm Verhungern retten konnten. Leider oder glücklicherweise leben die meisten von uns aktuell in der westlichen Welt ohne Hungerperioden. Deshalb ist es wichtig, unserem Körper zumindest einmal pro Tag eine Pause der Kohlenhydratzufuhr zu gönnen und ihn quasi dazu ,,zwingen“ an die Fettreserve zu gehen. Es dauert unterschiedlich lange, bis der Körper Fett abbaut, abhängig von dem, was ihm vorher zugeführt wurde, wie hoch sein Grundumsatz ist, wieviel er sich bewegt und wie kalt es ist. Wenn kein Zucker mehr da ist (Kohlenhydrate werden im Körper zuerst in Zucker umgebaut), baut er Glykogen (aus den Leberzellen) ab und erst danach verbrennt er Fett aus den Fettzellen. Man muss bei normalem Stoffwechsel mindestens mit 10 Stunden rechnen, bis das in größerem Umfang passiert. Beim Intervallfasten (12 Stunden) hat der Körper also idealerweise zwei Stunden zum Fettabbau Zeit. Bei sehr langsamen Stoffwechsel kann es aber auch sein, dass es länger braucht, bis Fett abgebaut wird. In dem Fall sollte man die Ursachen überprüfen, evtl. steckt ein Schilddrüsenunterfunktion oder ein Bewegungsmangel dahinter. Es gibt auch spezielle Nahrungsmittel , die den Stoffwechsel insgesamt anregen, z.B. Ingwer oder Chili. Ansonsten muss man das Intervallfasten ausdehnen, z.B. auf 14/10.
Intervallfasten ist gerade für einen Patienten mit metabolischem Syndrom eine sinnvolle Option, wobei wichtig ist, inwieweit die Insulinresistenz des Patienten bereits fortgeschritten ist und wie die Compliance einzuschätzen ist. Denn regelmäßige Blutzuckermessungen sind, besonders am Anfang, unabdingbar, um einer Hypoglykämie entgegenzuwirken. Zudem ist eine ausgewogene Ernährung, während der Essensfenster wichtig, die alle notwendigen Nährstoffe enthält.
Hier sind die Vorteile des Intervallfastens für einen Patienten mit metabolischem Syndrom:
- Verbesserung der Insulinsensitivität, was hilft, das Risiko für Typ-2-Diabetes zu verringern.
- Gewichtsreduktion durch die Begrenzung der Essenszeiten und damit Kalorienreduktion.
- Reduktion von Entzündungsmarkern.
- Verbesserung des Lipidprofils, insbesondere Triglyceride und teilweise auch Cholesterinwerte.
Die einfachste Form des Intervallfastens ist es , 12 Stunden nichts zu essen, danach 12 Stunden Essen (12/12), strengere Möglichkeiten sind 14/10 oder 16/8 (täglich 14 bzw. 16 Stunden fasten, 19 bzw. acht Stunden Essensfenster). Das Ganze geht auch tageweise, z.B. 6:1 oder 5:2 (ein oder zwei Tage pro Woche stark kalorienreduziert, sechs oder fünf Tage normale Ernährung). Diese sollten individuell angepasst und in den Gesamtbehandlungsplan integriert werden. Dabei sollte aber auch die Toleranz des Betreffenden beachtet werden. 12/12 als fester, täglicher Bestandteil mit ,,Free-Time“ am Wochenende (Samstag/Sonntag), wobei dann oft sowieso länger geschlafen wird, ist besser als ein 16/8 Schema, das nur für eine kurze Zeit durgehalten wird., weil es vom ,,normale“ Verhalten, dass sich über Jahrzehnte gefestigt hat, zu sehr abweicht.
Insgesamt könnte Intervallfasten eine hilfreiche Komponente in der Behandlung und Prävention des metabolischen Syndroms dieses Patienten sein, sofern es sorgfältig geplant und überwacht wird.
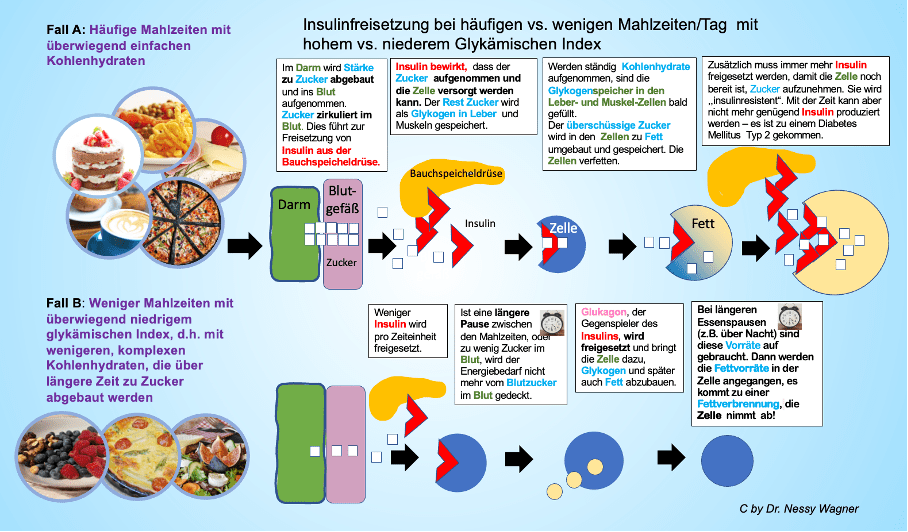
Abbildung 5: Bedeutung der Häufigkeit und der Art der Kohlenhydrate für die Insulinfreisetzung.
Neue Ansätze und Technologien in der Nährstoffforschung und Bedeutung der personalisierten Ernährungsansätze
Erst in den letzten Jahren haben sich durch den rasanten Fortschritt neuer Technologien zahlreiche Möglichkeiten aufgetan, die auf die individualisierte Behandlung des metabolischen Syndroms abzielen. Im folgenden Abschnitt werden exemplarisch drei medizinischen Besonderheiten des Patienten, die man heute schon bestimmen kann, wie Genetik, Stoffwechselprodukte und Mikrobiom, vorgestellt. Allerdings darf dabei die Grundlage einer solchen Behandlung, das individuelle Coping verschiedener Behandlungsansätze, nicht vernachlässigt werden, wobei hierfür auf eine ausführliche, gezielte Anamnese nicht verzichtet werden kann
1. Genetische Tests zur Vorbeugung und Behandlung des metabolischen Syndroms
In jüngster Zeit werden zunehmend auch genetischer Tests zur Erstellung von individuellen Risikoprofilen verwendet, mit denen man Reaktionen auf Ernährungs- und Lebensstiländerungen erkennen kann.
Identifizierung genetischer Prädispositionen: Genetische Tests können Marker identifizieren, die mit einem erhöhten Risiko für die Komponenten des metabolischen Syndroms wie Insulinresistenz, Fettleibigkeit, Dyslipidämie und Hypertonie verbunden sind. Beispielsweise können genetische Marker aufzeigen, wie ein Individuum Fette metabolisiert, was direkte Auswirkungen auf das Risiko für Fettleibigkeit und Typ-2-Diabetes hat. Dies ermöglicht eine frühzeitige Intervention, bevor klinische Symptome auftreten.
Personalisierte Behandlungsstrategien: Auf der Basis genetischer Informationen können spezifische Ernährungs- und Bewegungsempfehlungen gegeben werden, die auf die individuellen Bedürfnisse des Einzelnen abgestimmt sind. Beispielsweise können genetische Variationen im FTO-Gen, das oft mit Fettleibigkeit in Verbindung gebracht wird, anzeigen, dass eine Person möglicherweise mehr von einer kalorienreduzierten Diät und einem spezifischen Typ körperlicher Betätigung profitiert.
Optimierung der Medikamententherapie: Genetische Tests können helfen, die Reaktion eines Individuums auf bestimmte Medikamente vorherzusagen, was besonders wichtig ist, da Patienten mit metabolischem Syndrom oft mehrere Medikamente gleichzeitig benötigen. Dies kann zur Vermeidung von unerwünschten Arzneimittelwirkungen und zur Erhöhung der Wirksamkeit der Behandlung beitragen.
2. Metabolomik
Dabei handelt es sich um die Analyse von kleinen Molekülen, den sogenannten Metaboliten. Diese sind Endprodukte beii verschiedenen Stoffwechselvorgängen in einem Organismus und spiegeln die biochemische Aktivität der Zellen wider. Die Analyse dieser Metaboliten kann die individuelle Reaktion auf Diäten zeigen zu personalisierenund detaillierte Stoffwechselprofile zu erstellen.Dies bieteteine wertvolle Grundlage für personalisierte Ernährungsstrategien, die auf die spezifischen Bedürfnisse und Reaktionen des Einzelnen zugeschnitten sind. Dieser Ansatz hat das Potenzial, die Prävention, das Management und die Behandlung des metabolischen Syndroms erheblich zu verbessern.
Durch die Identifizierung spezifischer Biomarker, die mit bestimmten metabolischen Zuständen wie Insulinresistenz oder Dyslipidämie verbunden sind, kann die Metabolomik helfen, Risikofaktoren für das metabolische Syndrom frühzeitig zu erkennen. Dies ermöglicht eine proaktive Anpassung der Ernährung, mit
individuell abgestimmte Diätplänn, die auf die spezifischen metabolischen Bedürfnisse und Reaktionen eines Individuums abgestimmt sind. Wenn beispielsweise festgestellt wird, dass eine Person Kohlenhydrate schlecht metabolisiert, kann eine Ernährung empfohlen werden, die reich an gesunden Fetten und Proteinen ist, um die Glukosehomöostase zu unterstützen.
Die Metabolomik ermöglicht eine kontinuierliche Überwachung der metabolischen Reaktionen auf Ernährungsänderungen. Diese Informationen können verwendet werden, um Ernährungspläne dynamisch anzupassen, um optimale Gesundheitsergebnisse zu erzielen und das Fortschreiten oder sogar die Umkehr des metabolischen Syndroms zu fördern.
Vorhersage von Diätreaktionen: Metabolomische Analysen können helfen vorherzusagen, wie ein Individuum auf eine bestimmte Diät reagieren wird, bevor diese umgesetzt wird. Dies kann besonders nützlich sein, um zeitaufwändige Versuche und Irrtümer bei der Auswahl der effektivsten und verträglichsten Ernährungsweise zu vermeiden.
Hier sind einige Beispiele für Metaboliten und ihre Rolle in verschiedenen biochemischen Aktivitäten:
- Glukose: Ein primärer Energielieferant für Zellen. Glukose wird im Prozess der Glykolyse abgebaut, um Energie in Form von ATP zu produzieren, was für alle zellulären Funktionen wesentlich ist.
- Acetyl-CoA: Ein zentraler Metabolit im Stoffwechsel, der aus der Oxidation von Pyruvat entsteht und eine Schlüsselrolle im Citratzyklus und der Fettsäuresynthese spielt.
- Kurzkettige Fettsäuren (SCFAs): Dazu gehören Butyrat, Propionat und Acetat, die hauptsächlich durch die bakterielle Fermentation von Ballaststoffen im Dickdarm produziert werden. SCFAs dienen als Energiequelle für Darmepithelzellen, regulieren den pH-Wert im Darm und spielen eine Rolle in der Entzündungshemmung und Insulinregulation.
- Stickstoffmonoxid (NO): Ein Metabolit, der eine wichtige Rolle bei der Signalübertragung in verschiedenen physiologischen Prozessen spielt, einschließlich der Vasodilatation und der neuronalen Kommunikation. NO wird durch das Enzym Stickstoffmonoxid-Synthase aus L-Arginin synthetisiert.
- Urea: Ein Abfallprodukt des Proteinstoffwechsels, das im Harnstoffzyklus in der Leber produziert wird. Urea wird durch die Nieren ausgeschieden und spielt eine wichtige Rolle bei der Regulation des Stickstoffhaushalts.
3. Das Darm-Mikrobiom
Die Analyse des Darm-Mikrobioms, hat sich als ein bedeutender Forschungsbereich in der Prävention und Behandlung des metabolischen Syndroms etabliert, allerdings werden die Erkenntnisse in der Praxis noch zu selten genutzt.
Sie bietet wertvolle Einblicke in die Wechselwirkungen zwischen Ernährung, Mikrobiota und Wirtsgesundheit, so dass man gezieltere Ernährungsempfehlungen, die nicht nur auf die Makro- und Mikronährstoffzufuhr, sondern auch auf die Modulation des Mikrobioms abzielen, geben kann. Diese Ansätze können helfen, das Risiko zu senken und die Lebensqualität der betroffenen Personen zu verbessern. Erst in den letzten Jahren hat man die umfassende Bedeutung des Mikrobioms erkannt:
So produzieren einige Bakterienstämme wie kurzkettige Fettsäuren (SCFAs), die entzündungshemmende Eigenschaften haben , oderkönnen auch direkt die Insulinsensitivität beeinflussen, indem sie die Fähigkeit des Körpers zur Insulin-Signalgebung verbessern, was besonders bei der Prävention und Behandlung von Insulinresistenz von Bedeutung ist. Das Mikrobiom hat aber auch Einfluss auf die Regulation des Energiestoffwechsels, indem es die Kalorienaufnahme und den Energieverbrauch beeinflusst.
Ein unausgeglichenes Mikrobiom kann zu einem gestörten Energiehaushalt führen, der Gewichtszunahme und Adipositas-assoziierte Erkrankungen fördert.
Modifikation durch Ernährung: Ernährungsinterventionen, die auf eine Modifikation des Mikrobioms abzielen, können dessen Zusammensetzung und Funktion verändern. Eine Ernährung, die reich an präbiotischen Fasern und Probiotika ist, fördert das Wachstum von nützlichen Bakterien und kann das Risiko für das metabolische Syndrom verringern.
Nahrungsmittel und Nahrungsbestandteile, die zur Aufrechterhaltung gesunder Mikrobiomstämme besonders nützlich sein können:
- Polyphenolreiche Lebensmittel: Polyphenole, die in vielen pflanzlichen Lebensmitteln vorkommen, können das Wachstum von Akkermansia stimulieren. Beispiele hierfür sind:
- Granatäpfel
- Trauben
- Beeren (Heidelbeeren, Brombeeren)
- Kakaoprodukte (dunkle Schokolade)
- Lebensmittel mit Omega-3-Fettsäuren: Diese Fettsäuren können entzündungshemmend wirken
Gute Quellen sind:
- Fettreiche Fische wie Lachs und Makrele
- Leinsamen und Chiasamen
- Ballaststoffreiche Lebensmittel: Unverdauliche Fasern werden im Dickdarm fermentiert und dienen bestimmten nützlichen Bakterien als Nahrung:
- Zwiebeln
- Knoblauch
- Lauch
- Bananen
- Spargel
- Topinambur
- Präbiotika: Bestimmte präbiotische Fasern wie Inulin und Fructooligosaccharide (FOS) können ebenfalls das Wachstum von Akkermansia fördern. Diese sind in vielen der oben genannten Lebensmittel enthalten und können auch als Nahrungsergänzungsmittel zugeführt werden.
Diagnostisches Potenzial: Die Mikrobiomanalyse bietet auch diagnostisches Potenzial, indem spezifische Mikrobiomprofile identifiziert werden, die mit dem Risiko für das metabolische Syndrom korrelieren. Dies kann zur Entwicklung von frühen diagnostischen Markern und zur personalisierten Medizin beitragen.
Bei der Untersuchung des Zusammenhangs zwischen Darm-Mikrobiom und metabolischem Syndrom sind insbesondere die Stämme Bacteroidetes und Firmicutes von Bedeutung. Forschungen zeigen, dass Veränderungen in der Zusammensetzung dieser Bakterienstämme mit Merkmalen metabolischer Störungen wie Fettleibigkeit und Insulinresistenz assoziiert sein können
(Anmerkung: Bacteroides ist eine Gattung innerhalb des Phylums (Stammes) Bacteroidetes.a Bacteroides-Arten sind spezifische Typen von Bakterien, die hauptsächlich im menschlichen und tierischen Darm gefunden werden. Sie spielen eine wesentliche Rolle bei der Verdauung von pflanzlichen Stoffen und bei der Modulation des Immunsystems. So sind sie sind für ihre Fähigkeit bekannt, komplexe Moleküle wie Polysaccharide zu verdauen, was sie zu einem wichtigen Bestandteil der Darmflora macht.)
Personen mit einem geringeren Anteil an Bacteroides und einem höheren Anteil an Firmicutes tendieren dazu, eine größere Fettmasse und schlechtere metabolische Marker zu haben.
Darüber hinaus spielt Akkermansia muciniphila, ein weiterer wichtiger Darmbakterienstamm, eine Rolle bei der Aufrechterhaltung der Darmbarriere und beeinflusst ebenfalls die Insulinresistenz positiv.
Die Stämme Prevotella copri und Bacteroides vulgatus können direkt den Stoffwechsel des Wirts beeinflussen, insbesondere in Bezug auf Insulinresistenz und Glukosemetabolismus. Diese Bakterien beeinflussen die Produktion von kurzkettigen Fettsäuren (SCFAs), die entzündungshemmende Eigenschaften haben und die Insulinsensitivität verbessern können.
Eine weitere wichtige Erkenntnis ist die Rolle von Darmbakterien bei der Produktion und Regulierung von Gallensäuren, die für die Fettverdauung und den Glukosestoffwechsel wichtig sind. Veränderungen im Gallensäurestoffwechsel durch das Mikrobiom können somit signifikante Auswirkungen auf das metabolische Syndrom haben. Es ist wichtig zu beachten, dass eine ausgewogene Ernährung, die reich an vielfältigen Pflanzenstoffen ist, generell die Diversität und Gesundheit des Mikrobioms fördert.
Prä- und probiotische und Empfehlungen zur Modulation des Mikrobioms:
- Präbiotika wie Inulin und Fructooligosaccharide (FOS) fördern das Wachstum dieser nützlichen Bakterien im Darm und können somit indirekt den Gallensäuremetabolismus und damit verbundene metabolische Prozesse unterstützen.
- Probiotika wie Lactobacillus und Bifidobacterium sind bekannt dafür, die Zusammensetzung und Funktion des Darmmikrobioms positiv zu beeinflussen. Sie können helfen, die Produktion und den Umsatz von Gallensäuren zu regulieren, was zu verbesserten metabolischen Funktionen führt.
Formularbeginn
Formularende
Einsatz von Metformin beim metabolischen Syndrom auch ohne manifesten Diabetes gerechtfertigt?
Metformin, traditionell als Diabetes-Medikament bekannt, wird zunehmend aufgrund seiner potenziellen Vorteile für die Altersprävention und zur Behandlung verschiedener nicht-diabetischer Zustände erforscht. Studien zeigen, dass Metformin die Lebensdauer verlängern und gesundheitliche Vorteile bieten kann, indem es Mechanismen aktiviert, die typischerweise durch Kalorienrestriktion beeinflusst werden. Insbesondere wirkt Metformin durch die Aktivierung von AMPK, einem wichtigen Regulator des Energiestoffwechsels, und kann entzündungshemmend wirken sowie die Herzgesundheit verbessern (Frontiers, ScienceDirect Artikel). Eine Anwendung kann also auch bei Insulinresistenz, wie sie bei metabolischem Syndrom vorliegt, erfolgen.
GLP-1-Rezeptoragonisten als Hilfsmittel zum Abnehmen
Die Behandlung von Übergewicht und Adipositas hat eine neue Dimension durch den Einsatz von GLP-1-Rezeptoragonisten, wie Semaglutid (Ozempic, Rybelsus): oder Dulaglutid (Trulicity ) erreicht. Ursprünglich zur Behandlung des Typ-2-Diabetes entwickelt, zeigen diese Medikamente erhebliches Potenzial bei der Gewichtsreduktion. Sie haben auch den Vorteil, dass sie das Risiko für Hypoglykämien im Vergleich zu anderen Diabetes-Medikamenten wie Sulfonylharnstoffen reduzieren und bei vielen Patienten zu einer Gewichtsreduktion führen. Diese Gewichtsreduktion ist oft größer als bei anderen vergleichbaren Medikamenten oder Lifestyle-Änderungen allein. Zusätzlich bieten diese Medikamente potenzielle kardiovaskuläre Vorteile, was sie besonders wertvoll für Patienten mit metabolischem Syndrom oder hohem kardiovaskulärem Risiko macht. Sie imitieren die Wirkung des natürlichen Hormons GLP-1.
GLP-1 oder Glucagon-like Peptide-1 ist ein Hormon, das natürlich im Körper vorkommt und eine Rolle bei der Regulierung des Appetits und der Kalorienaufnahme spielt. Für Patienten, die mit Adipositas kämpfen, können GLP-1-Rezeptoragonisten eine wirksame Lösung bieten, vor allem wenn traditionelle Methoden wie Diät und Bewegung nicht ausreichen. Das Problem ist, dass sie derzeit in Apotheken knapp sind. Eine Möglichkeit ist, auf solche GLP-1-Rezeptoragonisten auszuweichen, die dafür nicht offiziell zugelassen sind, z.B. Tirzepatid (mournjaro, siehe unten).
Wirkmechanismus
GLP-1-Rezeptoragonisten ahmen die Wirkung von natürlichem GLP-1 nach, indem sie
- die Insulinsekretion postprandial erhöhen,
- die Glukagonsekretion reduzieren,
- die Magenentleerung verlangsamen und
- das Sättigungsgefühl verstärken, was zu einer verringerten Nahrungsaufnahme führt.
Tirzepatid (Markenname: Mounjaro) ist ein neuartiges Medikament zur Behandlung von Typ-2-Diabetes, das von Eli Lilly entwickelt wurde. Es ist ein dualer Glukose-abhängiger insulinotropher Polypeptid- (GIP-) und GLP-1-Rezeptoragonist, der sowohl den GIP- als auch den GLP-1-Rezeptor im Körper aktiviert, wobei GIP (Glucose-dependent Insulinotropic Polypeptide) die Insulinsekretion in Abhängigkeit vom Blutzuckerspiegel fördert und die die Glukagonsekretion reduziert, ein Hormon, das die Glukoseproduktion in der Leber stimuliert. Durch die Kombination mit GLP-1 (Glucagon-like Peptide-1) kann Tirzepatid effektiv den Blutzuckerspiegel kontrollieren und gleichzeitig den Appetit regulieren, was zu einer signifikanten Gewichtsreduktion führt.
Tirzepatid wird in Form einer subkutanen Injektion verabreicht. Es wird einmal wöchentlich injiziert, was die Compliance im Vergleich zu Medikamenten, die häufiger eingenommen werden müssen, verbessern kann.
Die SURPASS-Studien, haben gezeigt, dass Tirzepatid bei der Blutzuckerkontrolle und Gewichtsreduktion hochwirksam ist. Es konnte den HbA1c-Spiegel signifikant senken und zu einer beträchtlichen Gewichtsabnahme führen. Die Nebenwirkungen halten sich im Rahmen,. Besonders am Anfang klagen manche patienten über Übelkeit, Erbrechen, Durchfall oder Appetitlosigkeit.
Durch die duale Aktivierung von GIP und GLP-1-Rezeptoren kommt es nicht nur zu einer effektive Blutzuckerkontrolle, auch bei der Gewichtsreduktion kann das Medikament Typ II Diabetiker signifikant unterstützen. Zudem ist die einmal wöchentliche Injektion relativ einfach und verbessert so die Patientencompliance.
Tirzepatid repräsentiert einen bedeutenden Fortschritt in der Behandlung von Typ-2-Diabetes, insbesondere für Patienten, die zusätzlich zur Blutzuckerkontrolle auch eine Gewichtsreduktion anstreben (Frias JP ;2021 NEJM)
In der SURPASS-Studie zeigte es im Vergleich zu Semaglutid bei Patienten mit Typ-2-Diabetes eine signifikant stärkere Senkung des HbA1c-Werts und eine größere Gewichtsreduktion
Kombinationstherapie von GLP-1-Rezeptoragonisten mit Metformin
Aktuell werden die beiden sicher und effektiv zur Behandlung von Typ-2-Diabetes eingesetzt, ohne das Risiko schwerer Hypoglykämien wesentlich zu erhöhen. Es besteht aber auch die Möglichkeit, diese bedien zu kombinieren.Hier sind einige Vorteile dieser Kombination:
- Verbesserte Blutzuckerkontrolle: Metformin und GLP-1-Rezeptoragonisten wirken auf unterschiedliche Weise, um den Blutzucker zu senken. Metformin reduziert die Glukoseproduktion in der Leber und verbessert die Insulinsensitivität, während GLP-1-Rezeptoragonisten die Insulinsekretion erhöhen und die Magenentleerung verlangsamen.
- Gewichtsmanagement: Beide Medikamente haben den Vorteil, dass sie potenziell gewichtsneutral sind oder zur Gewichtsabnahme führen können, was bei der Behandlung von Typ-2-Diabetes besonders wünschenswert ist. GLP-1-Rezeptoragonisten sind insbesondere dafür bekannt, dass sie das Sättigungsgefühl erhöhen und den Appetit verringern können.
- Reduziertes Risiko für Hypoglykämie: Während einige Diabetesmedikamente das Risiko einer Hypoglykämie erhöhen können, ist das Risiko bei der Kombination von Metformin mit GLP-1-Rezeptoragonisten relativ gering, da keines der Medikamente direkt die Insulinsekretion stimuliert, wie es bei Sulfonylharnstoffen der Fall ist.
- Kardiovaskuläre Vorteile: Einige GLP-1-Rezeptoragonisten haben gezeigt, dass sie kardiovaskuläre Vorteile bieten, wie die Reduktion von Herzinfarkten und Schlaganfällen bei Personen mit Typ-2-Diabetes. Metformin hat auch einen positiven Effekt auf das kardiovaskuläre Risikoprofil.

Abbildung 7: Beispiel einer modernen Behandlung eines Patienten mit metabolischem Syndrom.
Erstellung eines individuellen, personalisierten Diätplans & Motivation
Mit denen im Artikel vorgestellten Möglichkeiten können Ärzte und Ernährungsberater individualisierte Ernährungspläne entwickeln, die auf die spezifischen Bedürfnisse und Risikofaktoren ihrer Patienten mit metabolischem Syndrom abgestimmt sind. Dies beinhaltet auch eine gründliche Auswertung der Ernährungsgewohnheiten und möglicher Nährstoffmängel ( Abbildung 7).
1. Erkenntnisse von Nährstoffanalysen, Genetik, Metabolomik und Mikrobiomik nutzen!
Basierend auf diesen Erkenntnissen und Technologien können wir als Ärzte, Heilpraktiker und/oder Patienten darauf achten, bei der Behandlung auf die Entwicklung personalisierter Diätpläne zu achten, die genau auf jeden Patienten abgestimmt sind. Die Maximal-Lösung davon wurde als letztes in diesem Artikel besprochen. Durch die neuen aufgezeigten Möglichkeiten sind wir dabei in der Lage, speziell auf die Vermeidung von Komponenten des metabolischen Syndroms wie Hypertonie, erhöhte Blutfettwerte und Insulinresistenz einzugehen. Diese Pläne berücksichtigen individuelle Unterschiede in der Nährstoffverarbeitung und genetische Prädispositionen, was sie potenziell effektiver macht als generische Diätempfehlungen, da sie auf den einzigartigen genetischen und metabolischen Profilen eines Individuums basieren, wodurch die Effektivität von Ernährungsinterventionen im Kontext des metabolischen Syndroms erheblich verbessert werden kann.
2. Anamnese als mindestens gleich wichtig einstufen!
Neben Blutuntersuchungen, die auch zur Differenzierung von Nährstoffmängeln genutzt werden können, hat sich aber auch die Erfragung der bisherigen Ernährungsgewohnheiten als besonders wichtig herausgestellt. Sie liefert uns zum einen wichtig Hinweise zu etwaigen Ernährungsmängeln, was uns bei der Diagnostik einer Mangelernährung mit der Notwendigkeit einer Supplementierung bestimmter Nährstoffe (häufig z.B. Jodmangel, Mangel an Vitamin D und K2, bei Vegetariern B-Vitamine) behilflich sein kann.
3. Berücksichtigen der persönlichen Individualität und Motivation
Zum andern gibt sie uns aber auch Hinweise zu den bisherigen Vorlieben und Wünsche des Patienten, denn wenn er sich mit der ,,neuen“ Ernährung nicht anfreunden kann, sind sämtliche Bemühungen vergeblich. Wir müssen also seine Vorlieben in das
Ernährungskonzept implementieren, damit er es tatsächlich dauerhaft durchführen kann. Hat man beispielsweise einen Menschen vor sich, der abends gewohnt ist, zu ,,knabbern“, sollte man zumindest Alternativ-Vorschläge wie Gemüse-Streifen mit Joghurt-Dips,… anbieten. Diesem abendlichen Hunger kann man aber langfristig auch begegnen, wenn man sich angewöhnt, ein gutes, nähr- und ballaststoffreiches Frühstück, z.B. mit Overnight-Oats (mit Leinsamen und Nüssen) und Obst zu essen, anstatt morgens, wenn man meist die größte Konzentrationsfähigkeit benötigt, zu fasten, was leider bei vielen Berufstätigen der Fall ist, weil sie morgens meist im Stress sind. Ein häufiges ,,Problem“ ist auch das ,,Kaffeestückchen“ um etwa 14 Uhr (postprandialer Abfall des Blutzuckers), auf das sich manche Menschen täglich aufs Neue freuen. Nein, Obst ist nicht dasselbe! Eine gewisse Kompromissfähigkeit auch auf Seiten des Therapeuten kann helfen, dass an anderer Stelle, bei der es weniger negativ ist, umso motivierter ,,vernünftig“ gegessen wird. Das A und O ist also, neben der neuen, technischen Möglichkeiten, die Motivation des Patienten! Um diese weiter zu stärken, ist es wichtig, ihn auf die ,,neue Kraft“ aufmerksam zu machen, die sich bei einer umfassenden, gesunden Ernährung nach etwa 2-3 Wochen einstellt.
Lassen Sie ihren Patienten Tagebücher führen (z.B. Dokumentation Ernährung/ Bewegung/ Stimmung) oder Apps verwenden, geben Sie ihm Tipps, wie er reagieren kann, wenn er schwach wird, ermutigen Sie ihn, je nach seiner Psyche Dinge zu tun, die ihn glücklich machen, nach draußen zu gehen, Leute zu treffen, eine Hund anzuschaffen und nebenbei jeden Tag auch ,,ein bißchen“ Sport zu treiben, Freude an der Bewegung zu entdecken…. und geben Sie ihm dabei das Gefühl, das Zepter selbst in der Hand zu haben!
4. Monitoring und Anpassung
Ein weiterer wichtiger Punkt ist die Überwachung: Regelmäßige Überwachung der Ernährungsfortschritte (z.B. am Anfang eine Woche, später alle zwei bis vier Wochen) und Anpassung der Ernährungspläne sowie Ergänzungsempfehlungen sind essenziell, um den langfristigen Erfolg sicherzustellen und Nebenwirkungen zu vermeiden. Der Patient muss das Gefühl haben, im Therapeuten einen Partner an seiner Seiten zu haben, der ihn unterstützt und der weiß, was zu tun ist, wenn sich Probleme ergeben.
Bauen Sie ,,Notfallpläne“ in das Gesamt-Konzept ein, damit die Motivation auch dann erhalten bleibt, wenn einmal nicht alle Vorgaben berücksichtigt wurden. Klären Sie ihren Patienten auf, dass einmal ,,Änderung des Plans“ nicht tragisch ist, aber zweimal hintereinander als inneres ,,No-Go“ betrachtet werden sollte!
Die Etablierung von Selbsthilfegruppen (z.B. mit ,,Patensystem“) wie in den USA bereits häufig etabliert, sind gute Methoden, dem Patienten langfristig auf neue Verhaltensmuster ,,umzuprogrammieren“.
5. Gesundheitspolitische Anpassung : Die Gesundheitspolitik in Deutschland muß sich an den tatsächlichen Bedarf der Klinischen Praxis orientieren und entsprechende Änderungen auf den Weg bringen!
Ja, das alles kostet Einfühlungsvermögen – und Zeit. Aber Vorläufer und das metabolische Syndrom selbst gehören zu den dringlichsten Problemen, mit dem die westliche Medizin derzeit konfrontiert ist. Was nützt alle teure Medizin, wenn wir diese beiden nicht mehr haben? Deshalb kann die Verantwortung mit den modernen Anforderungen der Medizin, die auf einem Überangebot an Nahrung beruhen, nicht allein auf die Therapeuten abgewälzt werden, auch die Organisation des Gesundheitswesens und damit auch die Politik sind gefragt. Denn abgesehen von den persönlichen Schicksalen, die das metabolischen Symptomenkomplexes mit sich bringt, sind die Kosten der Behandlung immens und belaufen sich in Deutschland auf etwa 63 Milliarden Euro jährlich. Die direkten Kosten machen dabei rund 29 Milliarden Euro aus, während die indirekten Kosten, die durch Produktivitätsverluste, krankheitsbedingte Arbeitsunfähigkeit und vorzeitige Berentung entstehen, etwa 34 Milliarden Euro betragen (Ernährungs Umschau).
Darüber hinaus erzeugt eine ungesunde Ernährung, die reich an Zucker, Salz und gesättigten Fetten ist, direkte Kosten von fast 17 Milliarden Euro jährlich für das deutsche Gesundheitssystem. Diese Summe beinhaltet lediglich die direkten Behandlungskosten für Krankheiten wie Herz-Kreislauf-Erkrankungen, Karies, Stoffwechselstörungen und einige Krebsarten, die durch solche Ernährungsgewohnheiten begünstigt werden können (Ernährungs Umschau).
Damit Therapeuten die Anforderungen erfüllen kann, die nötig sind, um eine personalisierte Ernährungsberatung- und Überwachung in die Standardtherapien von Patienten des metabolischen Symptomenkomplexes zu etablieren und Schulungen und Weiterbildungen zu dem Thema zu besuchen, erfordert es auch ein Umdenken und Eingreifen der Gesundheitspolitik.
Folgende Punkte müssen dabei berücksichtigt werden:
- Förderung gesunder Lebensmittel: Die öffentliche Gesundheitspolitik sollte Maßnahmen umfassen, die den Zugang zu und den Verbrauch von gesunden Lebensmitteln erleichtern, insbesondere in sozioökonomisch schwächeren Gebieten.
- Aufklärungskampagnen: Effektive öffentliche Aufklärungskampagnen sind erforderlich, um das Bewusstsein für die Bedeutung einer gesunden Ernährung zu schärfen und die Prävalenz des metabolischen Syndroms zu verringern.
- Subventionen und Steueranreize: Die Regierung könnte Subventionen für gesunde Lebensmittel und Steueranreize für Unternehmen bieten, die gesunde Ernährungsoptionen fördern.
- Förderungsprogramme für die weitere Erforschung des Mikrobioms und Ernährung sowie der Langzeitwirkungen von Nahrungsergänzungsmitteln: Hier besteht der Bedarf an langfristigen Studien, die unabhängig von der Industrie die Wirkung von Nahrung und Nahrungsergänzungsmitteln untersuchen, insbesondere in Bezug auf ihre Rolle bei der Prävention und Behandlung von Stoffwechselerkrankungen.
- Förderung der technischen Erforschung weiterer diagnostischer und therapeutischer Innovationen, beispielsweise der Vereinfachung der Eigendiagnostik von Blutzucker und weiterer Parametern.
Man sieht, dass bezüglich der Prävention und Behandlung des metabolischen Systems noch viel getan werden muss, um das Problem wirklich in den Griff zu bekommen. Dennoch bleibt zu hoffen, dass sich das Problem nicht von alleine löst und durch ein weit Größeres ersetzt wird: Dann nämlich, wenn sich das Gros der Menschen keine Sorge mehr um die Überversorgung machen müssen, weil die Nahrung , die wir haben, nicht mehr ausreicht, um die Menschen überhaupt kalorisch ausreichend zu versorgen – ein Problem, dass durch Überkonsum, aber auch durch Unvernunft getriggert wird, genau wie das Problem des Metabolischen Syndroms.
Durch einen ganzheitlichen Ansatz, der Ernährung, Bewegung und gegebenenfalls Nahrungsergänzungsmittel umfasst, können Patienten mit metabolischem Syndrom ihr Risiko für Komplikationen deutlich reduzieren und ihre allgemeine Gesundheit verbessern.
Literaturlisten
zum Nachlesen für Laien z.B. SpringerLink, AOK, NetDoktor
Verständnis des metabolischen Syndroms
Alberti, KGMM, Zimmet, P., & Shaw, J. (2006). Metabolic syndrome—a new world-wide definition. A Consensus Statement from the International Diabetes Federation. Diabetic Medicine, 23(5), 469-480.
Grundy, S. M., Cleeman, J. I., Daniels, S. R., Donato, K. A., Eckel, R. H., Franklin, B. A., … & Costa, F. (2005). Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation, 112(17), 2735-2752.
Hanefeld M, et al. Geschichte und Definition(en) des metabolischen Syndroms; Internist. Februar 2007;48(2):117–25
Reaven, G. M. (1988). Role of insulin resistance in human disease. Diabetes, 37(12), 1595-1607.
Nährstoffmängel bei Personen mit metabolischem Syndrom
Bray, G. A., & Bouchard, C. (Eds.). (2014). Handbook of Obesity – Volume 2: Clinical Applications, Fourth Edition. CRC Press.
Ford, E. S., Mokdad, A. H., & Liu, S. (2005). Healthy eating index and C-reactive protein concentration: findings from the National Health and Nutrition Examination Survey III, 1988-1994. European Journal of Clinical Nutrition, 59(2), 278-283.
Larsson, S. C., & Orsini, N. (2008). Magnesium intake and risk of type-2 diabetes: a meta-analysis. Journal of Internal Medicine, 262(2), 208-214
Pittas, A. G., Lau, J., Hu, F. B., & Dawson-Hughes, B. (2007). The role of vitamin D and calcium in type 2 diabetes. A systematic review and meta-analysis. The Journal of Clinical Endocrinology & Metabolism, 92(6), 2017-2029
(6), 1731S-1740S
Auswirkungen der modernen Ernährung auf molekulare Veränderungen
Popkin, B. M., Adair, L. S., & Ng, S. W. (2012). Now and then: The global nutrition transition: The pandemic of obesity in developing countries. Nutrition Reviews, 70(1), 3-21.
Malik, V. S., Popkin, B. M., Bray, G. A., Després, J. P., & Hu, F. B. (2010). Sugar-Sweetened Beverages, Obesity, Type 2 Diabetes, and Cardiovascular Disease risk. Circulation, 121(11), 1356-1364.
O’Keefe, J. H., Gheewala, N. M., & O’Keefe, J. O. (2008). Dietary Strategies for Improving Post-Prandial Glucose, Lipids, Inflammation, and Cardiovascular Health. Journal of the American College of Cardiology, 51(3), 249-255.
Zusammenhang zwischen Jodmangel und metabolischem Syndrom
Pearce, E.N., et al. (2022). Iodine deficiency and obesity: Is there a connection? Journal of Clinical Endocrinology & Metabolism.
Laurberg, P., et al. (2019). Jod und metabolisches Syndrom: Eine Übersicht. Thyroid.
Manousou, S., et al. (2021). Iodine status and metabolic syndrome: A population-based study. Thyroid Research.
Ernährung bei Adipositas
Smith, John et al. „Impact of Dietary Changes on Obesity Management.“ Nutrition Journal, vol. 15, no. 3, 2018, pp. 34-42.
Miller, Alice & Brown, Henry. „Role of Brown and White Adipose Tissue in Obesity.“ Journal of Clinical Endocrinology & Metabolism, vol. 98, no. 6, 2019, pp. 123-129.
Greenwood, Danielle C. et al. „Nutritional Approaches to Prevent Obesity: A Review.“ American Journal of Clinical Nutrition, vol. 107, no. 1, 2020, pp. 115-123.
Patel, Sanjay K. „Chromium and Its Role in Obesity and Metabolic Syndrome.“ Journal of Nutritional Biochemistry, vol. 29, no. 2, 2021, pp. 45-51.
Thompson, Richard et al. „Psychological Aspects of Dietary Behaviour and Obesity.“ Obesity Reviews, vol. 22, no. 7, 2022, pp. 154-160.
Metabolisches Syndrom
Saklayen, M. G. (2018). The Global Epidemic of the Metabolic Syndrome. Current Hypertension Reports, 20(2):12. DOI: 10.1007/s11906-018-0812-z.
Arnlov, J., Sundstrom, J., Ingelsson, E., Lind, L. (2020). Impact of BMI and the Metabolic Syndrome on the Risk of Diabetes and Cardiovascular Disease. Experimental Diabetes Research, 2020, Artikel ID 1019253. DOI: 10.1155/2020/1019253
Brown, J. E., & Harhay, M. O. (2021). Metabolic Syndrome: From Epidemiology to Systems Biology. Nature Reviews Endocrinology, 17(3): 297-308. DOI: 10.1038/s41574-020-00462-7
Monteiro, R., & Azevedo, I. (2021). Chronic Inflammation in Obesity and the Metabolic Syndrome. Mediators of Inflammation, 2021, Artikel ID 2894818. DOI: 10.1155/2021/2894818
Fernandez-Mendoza, J., & Vgontzas, A. N. (2022). Sleep Disorders and the Development of Insulin Resistance and Obesity. Endocrine Reviews, 43(4): 450-468. DOI: 10.1210/er.2021-00219
Mirmiran, P., et al. (2023). Dietary fatty acid patterns and risk of metabolic syndrome: Tehran lipid and glucose study. European Journal of Medical Research.
Mahan, L. K., & Raymond, J. L. (2020). Krause’s Food & the Nutrition Care Process.
Dietary Determinants of Metabolic Syndrome: Focus on the Obesity and Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD).
Proteinversorgung in Bezug auf das metabolische Syndrom
Barnard N.D., Levin S.M., Yokoyama Y. (2015). A systematic review and meta-analysis of changes in body weight in clinical trials of vegetarian diets. Journal of the Academy of Nutrition and Dietetics.
Obst- und Gemüsekonsum und dessen Auswirkungen auf das metabolische Syndrom
Lim M, Kim J. Association between fruit and vegetable consumption and risk of metabolic syndrome determined using the Korean Genome and Epidemiology Study (KoGES). Eur J Nutr. 2019.
Associations of vegetable and fruit consumption with metabolic syndrome. A meta-analysis of observational studies. Public Health Nutrition.
Literatur zur Nährstoffsupplementierung bei metabolischem Syndrom
Saraf-Bank, S., et al. (2014). Effects of vitamin D supplementation on the metabolic syndrome: a systematic review and meta-analysis. Diabetology & Metabolic Syndrome.
DOI: 10.1186/1758-5996-6-142
Al-Daghri, N.M., et al. (2017). Omega-3 fatty acids and the metabolic syndrome: a review of the evidence. The American Journal of Clinical Nutrition. Link: ajcn.nutrition.org
Zhang, X., et al. (2020). Zinc supplementation for the prevention of type 2 diabetes mellitus in adults with insulin resistance. Cochrane Database of Systematic Reviews. DOI: 10.1002/14651858.CD011176.pub2
Magnesium in Obesity, Metabolic Syndrome, and Type 2 Diabetes (2021). Nutrients. Link: Nutrients 2021, 13(2), 320
Lothar-Andreas Hotze, Petra-Maria Schumm-Draeger: Schilddrüsenkrankheiten. Diagnose und Therapie.) Berlin 2003, ISBN 3-88040-002-4.
Heinrich Kasper: Ernährungsmedizin und Diätetik. 11. Auflage. München 2009, ISBN 978-3-437-42012-2.
Molly Triffin; Sport verursacht oxidativen Stress; 31. August 2021; Livestrong.com
Hindawi; Pizzino, Gabriele et.al ; Oxidative Medicine and Cellular Longevity y Oxidative Stress: Harms and Benefits for Human Health ; Volume 2017, Article ID 8416763, 13 pages https://doi.org/10.1155/2017/8416763
National Institutes of Health (NIH): Laut NIH können sehr hohe Dosen von Vitamin C (über 2000 mg pro Tag) zu gastrointestinalen Störungen wie Durchfall und Nierensteinen führen.
Padayatty et al., Annals of Internal Medicine, 2004: Hohe Dosen von intravenösem Vitamin C sind bei Krebspatienten toxisch und können das Wachstum von Tumoren möglicherweise fördern.
MSD Manual: Hohe Dosen von Selen (>900 µg/Tag) können zu Toxizität führen.
Burk et al., Cancer Epidemiology Biomarkers & Prevention, 2006: Übermäßige Selenzufuhr gesundheitsschädlich.Formularbeginn
NIH (National Institutes of Health): Diese Quelle beschreibt die Risiken und Nebenwirkungen von hochdosiertem Vitamin C, einschließlich der erhöhten Oxalatausscheidung und des Risikos von Nierensteinen
MSD Manual: Symptome und Risiken von Vitamin C Überdosierung und deren Auswirkungen auf die Nieren
Padayatty et al., Annals of Internal Medicine, 2004: Hochdosiertes Vitamin C kann bei bestimmten Patienten toxisch sein.
Rolle von Knoblauch auf das metabolische SyndromFormularende
Rahman, K., & Lowe, G. M. (2006). Garlic and cardiovascular disease: a critical review. Journal of Nutrition, 136(3 Suppl), 736S-740S.
Ried, K., Toben, C., & Fakler, P. (2013). Effect of garlic on serum lipids: an updated meta-analysis. Nutrition Reviews, 71(5), 282-299..
Banerjee, S. K., & Maulik, S. K. (2002). Effect of garlic on cardiovascular disorders: a review. Nutrition Journal, 1, 4.
Ried, K., Frank, O. R., Stocks, N. P., Fakler, P., & Sullivan, T. (2008). Effect of garlic on blood pressure: a systematic review and meta-analysis. BMC Cardiovascular Disorders, 8, 13.
Rolle genetischer Tests in der Vorbeugung und Behandlung des metabolischen Syndroms
Formularbeginn
Formularende
Li, J., et al. (2020). Genetic testing for prevention and treatment of metabolic syndrome: A comprehensive review. Metabolism Clinical and Experimental, 112, 154266.
DOI: 10.1016/j.metabol.2020.154266
Ramos, E., et al. (2021). Personalized nutrition for metabolic syndrome management: The role of genetic testing. Nutrition Reviews, 79(7), 823-835.
DOI: 10.1093/nutrit/nuaa125
Johnson, L.A., et al. (2019). Integrative genetic approaches for understanding the metabolic syndrome. Diabetes & Metabolic Syndrome: Clinical Research & Reviews, 13(4), 2409-2414.
Singh, S., et al. (2022). Genetic predictors of metabolic syndrome and the potential role for genomic medicine. Genomics, 114(1), 110-118.
DOI: 10.1016/j.ygeno.2021.06.013FormularbeginnFormularende
Diätische Fette und metabolisches Syndrom
Mirmiran, P., et al. (2023). Dietary fatty acid patterns and risk of metabolic syndrome: Tehran lipid and glucose study. European Journal of Medical Research.
Mahan, L. K., & Raymond, J. L. (2020). Krause’s Food & the Nutrition Care Process.
Dietary Determinants of Metabolic Syndrome: Focus on the Obesity and Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD). IntechOpen.
Rolle der Mikrobiom- und Metabolomik-Analyse bei der Prävention und Behandlung des metabolischen Syndrom
de Toro-Martín, J., Arsenault, B. J., Després, J. P., & Vohl, M. C. (2021). Precision Nutrition: A Review of Personalized Nutritional Approaches for the Prevention and Management of Metabolic Syndrome. Nutrients, 13(2), 636.
Kashtanova, D. A., et al. (2021). Gut microbiota-derived metabolites as central regulators in metabolic disorders. Gut.
National Institutes of Health (NIH). (2010). Gut Bacteria May Influence Metabolic Syndrome. NIH Research Matters.
Dumas, M. E., et al. (2020). Metabolomics for personalized medicine: the input of analytical techniques. Analytical and Bioanalytical Chemistry, 412(21), 5127-5141..
DOI: 10.1007/s00216-020-02763-2
Brennan, L., et al. (2021). Nutritional metabolomics: Recent developments and future needs. Current Opinion in Clinical Nutrition and Metabolic Care, 24(4), 399-405.
Die Rolle von Darmbakterien bei der Produktion und Regulierung von Gallensäuren und deren Einfluss auf das metabolische Syndrom
Li, T., & Chiang, J. Y. L. (2020). Bile Acid Metabolism and Signaling: Potential Therapeutic Target for Metabolic Diseases. Journal of Lipid Research, 60(2), 312-317.
Sayin, S. I., Wahlström, A., Felin, J., Jäntti, S., Marschall, H. U., Bamberg, K., Angelin, B., Hyötyläinen, T., Orešič, M., & Bäckhed, F. (2013). Gut Microbiota Regulates Bile Acid Metabolism by Reducing the Levels of Tauro-beta-muricholic Acid, a Naturally Occurring FXR Antagonist. Cell Metabolism, 17(2), 225-235.
Joyce, S. A., & Gahan, C. G. M. (2016). The gut microbiota and the metabolic health of the host. Current Opinion in Gastroenterology, 30(2), 120-127.
Intervallfasten und dessen Einfluss auf das metabolische Syndrom.
Patterson, R.E., & Sears, D.D. (2017). Metabolic Effects of Intermittent Fasting. Annual Review of Nutrition.
Kosieradzka, K., et al. (2023). Exploring the Impact of Intermittent Fasting on Metabolic Syndrome, Prediabetes and Type 2 Diabetes: a systematic review. Journal of Education, Health and Sport.
Longo, V.D., & Mattson, M.P. (2014). Fasting: Molecular Mechanisms and Clinical Applications. Cell Metabolism.
Vorteile von Metformin außerhalb der Diabetesbehandlung
Barzilai, N., et al. (2016). Metformin as a Tool to Target Aging. Cell Metabolism, 23(6), 1060-1065.
Martin-Montalvo, A., et al. (2013). Metformin improves healthspan and lifespan in mice. Nature Communications, 4, 2192.
Campbell, J. M., et al. (2017). Metformin reduces all-cause mortality and diseases of ageing independent of its effect on diabetes control: A systematic review and meta-analysis. Ageing Research Reviews, 40, 31-44.
GLP-1-Rezeptoragonisten als Hilfsmittel zum Abnehmen
Astrup, A., et al. (2021). GLP-1 Receptor Agonists for Individualized Treatment of Obesity. The Lancet, 397(10271), 259-272.
Davies, M., et al. (2018). Efficacy of Liraglutid in Weight Management among Patients with Type 2 Diabetes: The SCALE Diabetes Randomized Clinical Trial. JAMA, 318(15), 1567-1577.
O’Neil, P.M., et al. (2018). Effects of Semaglutid in Patients with Obesity without Type 2 Diabetes: A Randomized Clinical Trial. New England Journal of Medicine, 378, 2413-2422.
Frias, J.P., Davies, M.J., Rosenstock, J., Pérez Manghi, F.C., Fernández Landó, L., Bergman, B.K., … & Liu, B. (2021). Tirzepatide versus Semaglutide Once Weekly in Patients with Type 2 Diabetes. New England Journal of Medicine, 385(6), 503-515. DOI: 10.1056/NEJMoa2107519



